DEMANDA DE TECNOLOGÍA SANITARIA
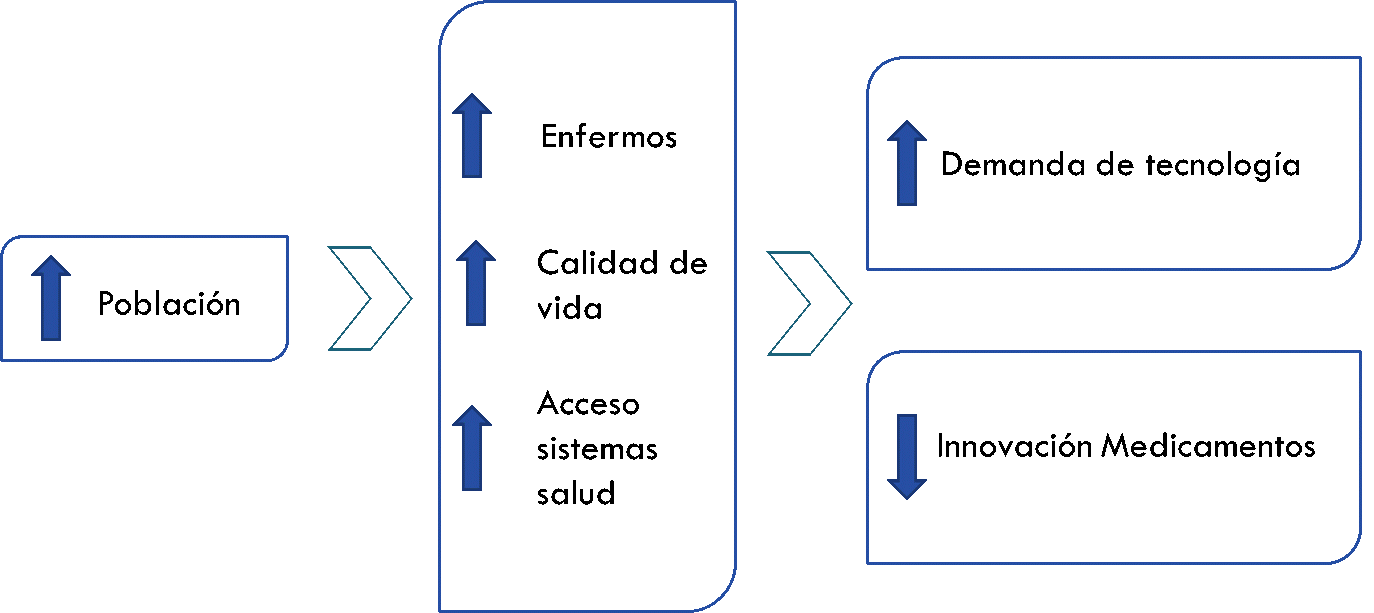
Diversos estudios han estimado qué en el año 2020 la población global llegará a 7,6 billones. El 9,4% serán mayores de 65 años frente al 7,3% que teníamos en 2010.
Este escenario inevitablemente conlleva un incremento de enfermos y un mayor número de ancianos que necesitarán atención médica.
Paralelamente, las mejoras en investigación han convertido algunas enfermedades terminales en crónicas, por consiguiente, necesitamos descubrir nuevas formas de mejorar la calidad de vida de los pacientes, es decir, hay una imperiosa necesidad de desarrollar nuevas terapias.
La resistencia a los fármacos, cada vez mayor, sobre todo a los antibióticos, pide soluciones.
El 30% de la población no hace ejercicio físico y el 20% padece obesidad o sobrepeso, lo que provoca un incremento de enfermedades cardiovasculares, diabetes…
Se habla también de que otros factores, como el efecto invernadero, incrementan el nivel de polen con el consecuente aumento de las enfermedades respiratorias.
Por otro lado, se estima que la demencia en mayores de 65 años llegará a duplicar sus cifras en 5 años y que este incremento se repetirá periódicamente.
Este escenario donde, se incrementan las secuelas propias de la vejez, las enfermedades mortales se cronifican y la innovación y desarrollo de fármacos está en descenso, es el mejor caldo de cultivo para la aparición de una tecnología sanitaria que, además cuenta con un acceso al mercado más sencillo y económico para la industria de la salud.
Gracias a esta tecnología sanitaria, en continuo auge, encontramos soluciones que ayudan a prolongar la vida y mejorar su calidad. Algunos ejemplos son:
- Detección precoz y diagnóstico: mamografía, colonoscopia, PET-RM, Biomarc.
- Tratamientos de mayor rapidez: cirugía laparoscópica, ultrasonidos en el tratamiento del ictus…
- Tratamientos más seguros: robots quirúrgicos
- Tratamientos más eficaces: radioterapia, marcapasos, desfribiladores automáticos implantables…)
- Tratamiento que mejoran la comodidad del paciente y del cuidador: prótesis de laringe, pulseras para demencia, equipos para ayudar a la movilidad…
Por último, hay que señalar que está tecnología supone también un beneficio económico, tanto a nivel de costes directos (derivados del cuidado del paciente) como indirectos (tiempo de baja del paciente)
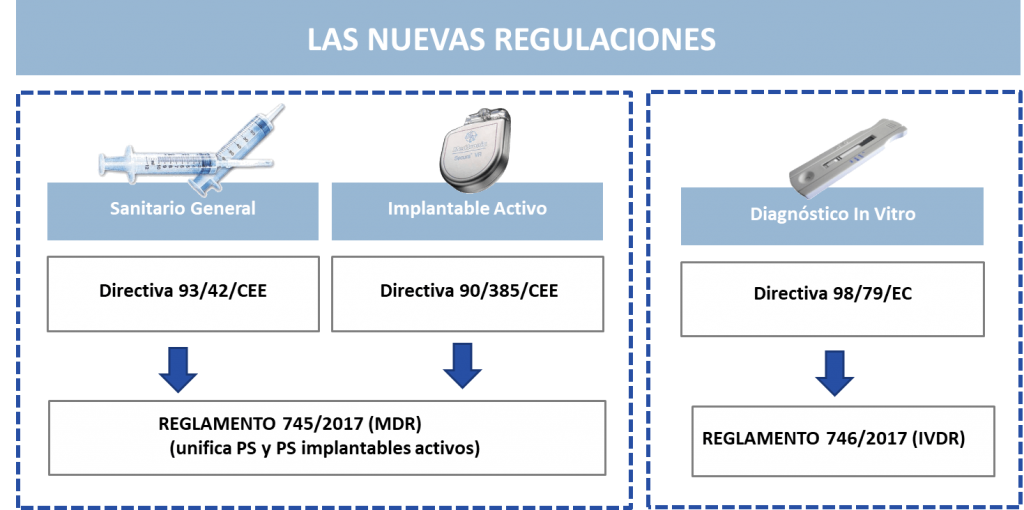
Es el incremento del uso de esta tecnología y la búsqueda de la seguridad de los pacientes y usuarios, lo que en 2012 llevó a la Comisión Europea a elaborar unos Reglamentos que sustituyeran a las actuales Directivas, ya que estas fueron publicadas en los años 90 y no están adaptadas a la tecnología actual.
Tenemos entonces el siguiente escenario: el Reglamento 745/2017 sustituye a las Directivas 93/42 y 90/385 y el Reglamento 746/2017 sustituye a la Directiva 98/79.
PLAZOS
Debemos tener en cuenta que a partir de mayo de 2020 solo se podrán expedir certificados de acuerdo con los Reglamentos, aunque se ha definido un periodo de vigencia donde los productos certificados de acuerdo a las Directivas puedan ponerse en el mercado hasta mayo de 2024.
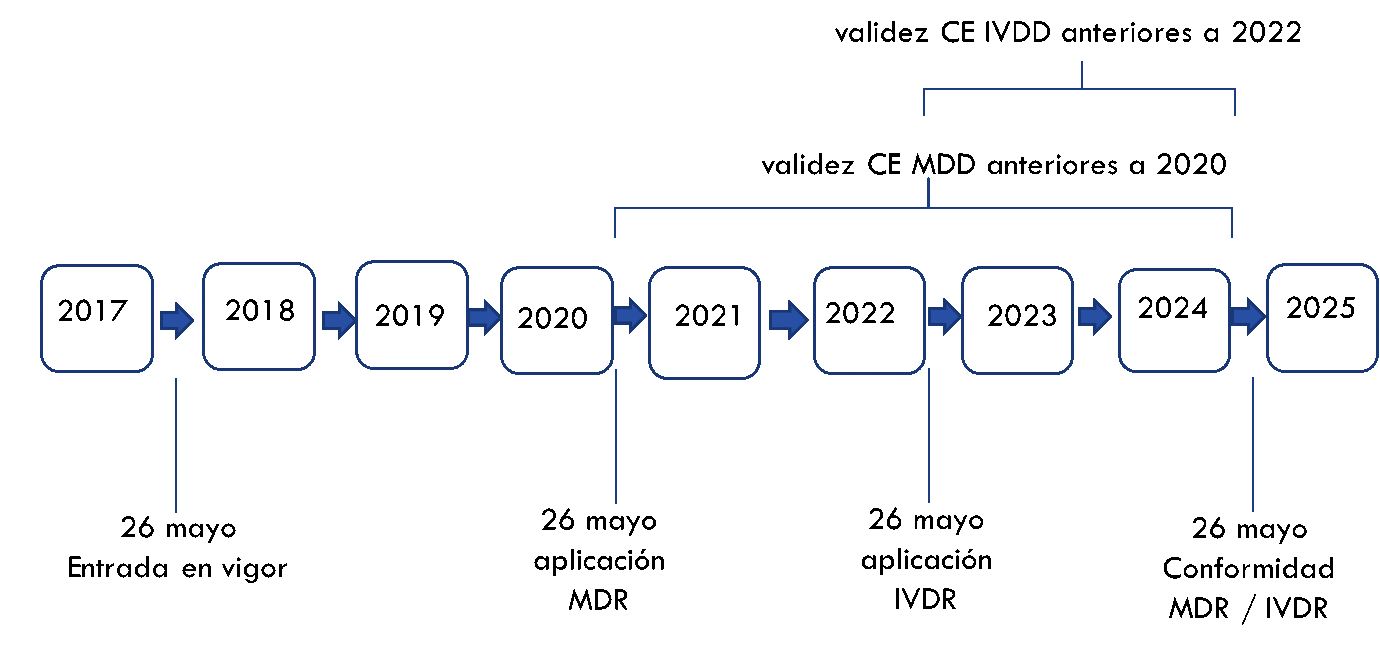
Durante este período, encontraremos productos cubiertos, tanto por el certificado expedido de conformidad con la Directiva como por el expedido de conformidad con el Reglamento.
Según informó la Comisión Europea, “ambos certificados tendrán igualdad de condiciones ante la ley y no habrá discriminación alguna en los criterios de admisibilidad de las licitaciones públicas”.
Igualmente, los certificados de libre venta podrán ser expedidos de acuerdo con las Directivas o los Reglamentos. Ambos tipos de certificados serán válidos.
Por lo tanto, podremos seguir introduciendo en el mercado productos conformes con las Directivas hasta que caduquen sus certificados vigentes, siempre y cuando los certificados ya existentes sean válidos y:
- Cumplan con un sistema de gestión de la calidad.
- No se cambie la finalidad y la naturaleza del producto.
- Sistema de vigilancia poscomercialización de acuerdo a los Reglamentos.
- Se realice el registro de los agentes económicos y los productos desde la fecha de aplicación.
¿QUÉ CAMBIA?
En general, los reglamentos mantienen los requisitos impuestos por las Directivas, aunque introducen otros nuevos de forma que se resalta la importancia de la seguridad durante todo el ciclo de vida del producto, así como la necesidad de disponer de datos clínicos.
Se introducen disposiciones mas estrictas en cuanto a:
– Designación de Organismos Notificados
- Mayor seguimiento de las autoridades Nacionales.
- Mayor seguimiento de la Comisión.
- Obligaciones de:
– Fabricantes
– Representantes Autorizados
– Importadores
– Distribuidores
Organismos Notificados
- Tendrán un sistema de designación compartido entre la Autoridad Nacional y un equipo auditor de la UE
- Recibirán auditorías de seguimiento durante las cuales se revisará la evaluación de los expedientes técnicos y de los datos clínicos realizada por estos ON.
- En caso de no cumplir con los requisitos establecidos en los Reglamentos, su autorización podrá ser retirada, suspendida o delimitadas sus funciones.
Respecto a los agentes económicos implicados en la cadena, los nuevos Reglamentos refuerzan las obligaciones de cada uno de ellos.

Importadores
Serán responsables de garantizar que los productos que introducen en el mercado cumplan las disposiciones de los Reglamentos y estén registrados en Eudamed.
Otras de sus obligaciones serán:
- Comunicar a los fabricantes y a los representantes autorizados las reclamaciones recibidas
- Indicar en el producto o su embalaje o en un documento anexo al producto su nombre, domicilio social y una dirección en la que se les puede contactar y que permita localizarlos
Distribuidores
Deberán realizar un muestreo de los productos que vayan a distribuir, de forma que se aseguren que los productos cumplen los Reglamentos. También son responsables de comunicar a los fabricantes o los representantes autorizados y a los importadores las reclamaciones y los incidentes que se les notifiquen.
Representantes autorizados
Deberán:
- Verificar que se han elaborado la declaración UE de conformidad y la documentación técnica y que el fabricante ha seguido el procedimiento pertinente de evaluación de la conformidad.
- Disponer de la documentación técnica, declaración UE de conformidad y certificados correspondientes.
- Cooperar con las autoridades en cualquier acción preventiva o correctiva.
- Comunicar al fabricante las reclamaciones e incidentes.
- Aparecer en el etiquetado.
Además, sus responsabilidades quedarán recogidas a través de un mandato escrito entre él y el fabricante.
Código de identificación única (UDI)
Los agentes económicos deben registrar los UDIs de los productos que suministren o que le sean suministrados.
La fecha límite para la asignación de UDI es la fecha de aplicación del Reglamento correspondiente. Sin embargo, la obligación de colocar el UDI en la etiqueta se cumplirá en tres etapas:
Productos Sanitarios
- Productos de la clase III: 26 de mayo de 2021.
- Productos de la clase II: 26 de mayo de 2023.
- Productos de la clase I: 26 de mayo de 2025.
Productos Sanitarios para diagnóstico in vitro
- Productos de la clase D: 26 de mayo de 2023.
- Productos de la clase B y C: 26 de mayo de 2025.
- Productos de la clase A: 26 de mayo de 2027.
Marcado CE: Aspectos Técnicos y Regulatorios
Cumplimiento con las actuales directivas y Reglamentos para la libre circulación dentro de la Unión Europea