Con este artículo, llegamos a la última parada de nuestro viaje dedicado al estudio de la actualización del Anexo 1. En los anteriores artículos, hemos observado con detalle las diferentes modificaciones que introduce esta actualización del Anexo a todos los niveles:
- Cambios estructurales
- Cambios en metodologías y operativas
- Cambios en tecnologías
- Cambios en control de calidad
Con cada etapa, hemos podido observar lo que ya intuíamos al inicio, esta actualización tiene un impacto importante a nivel regulatorio y de requerimientos en todas las áreas de fabricación de productos estériles. Este hecho implicará, en mayor o menor medida, que los laboratorios de fabricación de medicamentos estériles se deban actualizar y adaptar a estas modificaciones. ¿Cómo saber entonces si cumplimos los requerimientos? Para contestar esta pregunta y asegurar que nuestras instalaciones y procedimientos mantienen el nivel de exigencia requerido, el propio Anexo 1 nos presenta ese término que ya dejamos entrever en el primer artículo: la Estrategia de Control de la Contaminación o Contamination Control Strategy (CCS).
CCS: requerimiento normativo y herramienta indispensable
La CCS será una parte integral del sistema de calidad que afecta a nuestras zonas de fabricación de productos estériles y se presenta en el propio Anexo 1 como un documento que debe definir todos los puntos críticos del proceso, los controles realizados, su efectividad y las medidas de monitorización para controlar todos los riesgos asociados con contaminación del producto. Adicionalmente esta CCS tiene que actualizarse de forma activa para dar lugar a mejoras en los métodos de fabricación y control.
Es decir, la CCS nos permitirá asegurar que cumplimos todos aquellos requerimientos exigidos en el Anexo 1 o detectar todos aquellos puntos en donde sean requeridas mejoras a nivel de instalación o procedimientos.
Además, esta CCS tiene que actualizarse de forma activa para dar lugar a mejoras en los métodos de fabricación y control, asegurando que todas aquellas mejoras necesarias se han implementado y que la estrategia sigue siendo efectiva a lo largo del tiempo.
Guía para la realización del documento CCS
Una vez establecida su importancia y necesidad, es inevitable plantearse cómo abordar la realización de este documento. Por su criticidad y alcance, la realización del documento CCS se prevé una tarea ardua y que, tal y como ya indica el propio Anexo 1, requerirá del trabajo de un equipo multidisciplinar y la inversión de tiempo/recursos para su planteamiento y redacción.
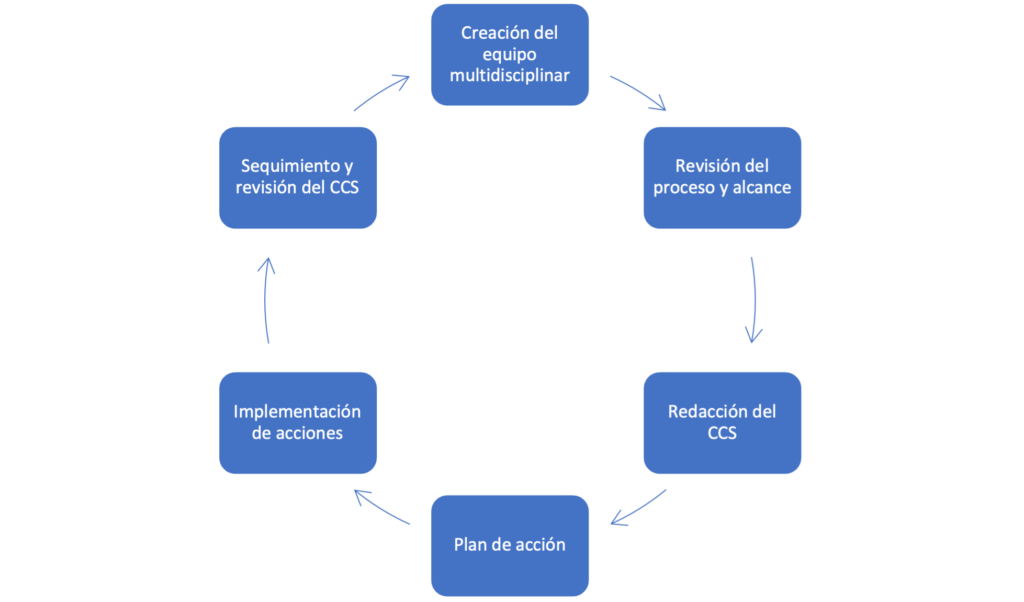
Como en la mayoría de las normativas y guías para la industria, se contemplan los requerimientos y la forma general en la que deben documentarse, pero sin una pauta clara establecida. Os proponemos los siguientes pasos para poder realizar este documento CCS de la forma más ágil posible y, de esta manera, realizar un estudio completo de nuestras zonas de producción estériles.
1. Creación del grupo multidisciplinar. Esta etapa es de suma importancia ya que tendrá un impacto substancial en la agilidad y calidad del estudio posterior. Para la realización del CCS será necesaria información de todos los factores que afecten a nuestra área de fabricación estéril y, por tanto, tendrán que estar implicados diferentes departamentos de la empresa para que cada uno pueda aportar información y experiencia en los procesos, instalaciones y políticas implantadas en la planta. A modo de ejemplo, el departamento de producción podrá aportar sus conocimientos mucho más profundos del proceso de fabricación mientras que el departamento de ingeniería podrá evaluar detalles de las instalaciones con más conocimiento.
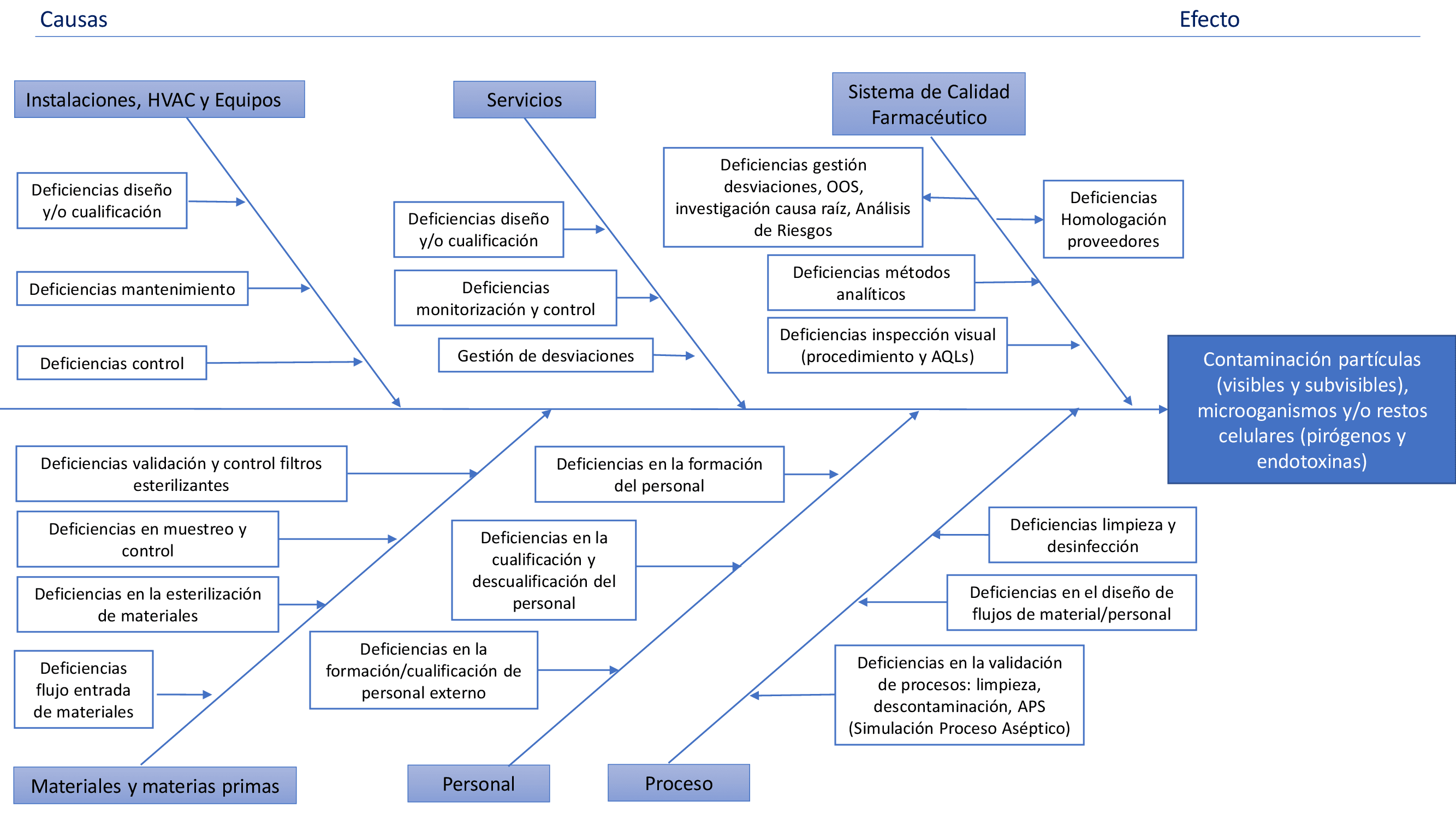
2. Revisión de los procesos de fabricación. Esta etapa permitirá identificar el alcance de nuestro CCS y poder identificar todos aquellos factores que afectan a la contaminación de nuestro producto. Siempre teniendo en cuenta la premisa del Anexo 1 de “minimizar el riesgo de contaminación microbiológica, por partículas y pirógenos en productos estériles”. En la imagen inferior se muestra un ejemplo de diagrama de Ishikawa donde se han incluido posibles causas de contaminación en los productos.
3. Identificación y estudio de los factores que afectan a las causas identificadas. En esta etapa ya podremos empezar la redacción del documento propiamente dicho. Se deberá realizar una revisión de las políticas, controles y monitorización realizados para minimizar la contaminación, a la vez que se identifica su adecuación al nuevo Anexo 1. Una forma de realizarlo es partiendo el estudio en bloques donde posteriormente se irá estudiando cada uno de los factores. Por ejemplo, estos bloques podrían ser:
- Instalaciones y HVAC
- Equipos
- Servicios
- Materiales
- Personal
- Sistema de calidad farmacéutico
- Proceso de fabricación
En el bloque de personal, por ejemplo, se estudiarán los diferentes procedimientos de flujos aplicables, las políticas de formación, los procedimientos de cualificación/descualificación del personal para trabajar en zona estéril y otros procedimientos que afecten a este bloque. Realizando este estudio para cada uno de los bloques, ya podremos identificar puntos de mejora si no se cumplen las exigencias del Anexo 1. Por ejemplo, se identificaría si no hay una política de recualificación periódica del personal o si alguno de los flujos no cumple lo establecido en la normativa.
4. Análisis de riesgos de causas de contaminación. Esto permitirá identificar los peligros derivados de cada una de las causas de contaminación, clasificándolos según su nivel de riesgo. Hay diferentes herramientas de gestión de riesgo para realizar este estudio y cada una presenta ventajas e inconvenientes. La que os proponemos es el Análisis Modal de Fallos y Efectos (AMFE) por la versatilidad que ofrece y la fácil clasificación en niveles de riesgo según su severidad, ocurrencia y detectabilidad.
5. Establecer un plan de acción y conclusiones. Con toda la información de estudio de los factores que afectan a la contaminación y la gestión de riesgos realizada, se deberán proponer acciones para reducir los riesgos a niveles aceptables y cumplir lo estipulado por normativa. Estas se documentarán en el propio documento CCS y estarán vinculadas a las diferentes acciones dentro de nuestro sistema de calidad. Esto nos permitirá concluir si nuestra estrategia de control de la contaminación es eficiente y tiene unos niveles adecuados para la fabricación de productos estériles.
Finalmente, se debe establecer una política de seguimiento y actualización de esta CCS para asegurar que esta estrategia es efectiva y va mejorando con el paso del tiempo y la experiencia adquirida.
Conclusiones mirando al futuro
Con todo lo visto en los diferentes artículos, esperamos que se haya cumplido el objetivo de este “viaje” a través del Anexo 1: conocer sus cambios y estar preparados para realizar el estudio de nuestra estrategia de control de la contaminación.
Este estudio será un elemento necesario cuando entre en vigor el nuevo Anexo 1 (esperemos que a lo largo de este 2022) y, sin duda, aquellos laboratorios que adelanten su implementación tendrán un conocimiento de su área estéril más profundo y estarán mejor preparados para cumplir la normativa. Desde Qualipharma os animamos a empezar a trabajar en él, ya que como dijo Alexander Graham Bell: “Antes que toda otra cosa la preparación es la clave del éxito“
Además, teniendo en cuenta la carga de trabajo que supondrá la realización del documento CCS, nuestro equipo de consultores puede dar soporte en su estudio/implementación. Este soporte empieza por formar parte de ese grupo multidisciplinar inicial hasta la realización del estudio y creación del documento CCS donde documentaremos el estado global del área de producción de estériles y su adecuación al nuevo Anexo 1.
Elabora con éxito tu CCS
En Qualipharma te damos soporte en el estudio e implementación de la Estrategia de Control de Contaminación.

2 comentarios
Francisco resendiz
Muy bueno
Lydia Herranz
¡Muchas gracias por tu comentario! Nos ayuda a seguir creando contenido de calidad e interés 🙂