INTRODUCCION
Todos los responsables de validaciones de limpieza ven que los criterios que han seguido hasta ahora y que tanto esfuerzo les ha costado implementarlos no les valen para los nuevos cambios que recientemente se han implementado.
NUEVAS NORMATIVAS
Los cambios recientemente implementados:
- Revisiones de los capítulos 3 y 5 de las GMP relativos a la prevención de contaminación cruzada
- EMA/CHMP/CVMP/SWP/169430/2012 “Guideline on setting health based exposure limits for use in risk identification in the manufacture of different medicinal products in shared facilities”.
- Nuevo anexo 15 de Cualificación y validación que entra en vigor en Octubre 2015
IMPLICACIONES DE LOS CAMBIOS
- Los límites de limpieza deben tener como dato de partida para su cálculo los datos toxicológicos de partida (PDE) de los principios activos que pasan por una línea.
- Se deben usar métodos específicos para la determinación de residuos de principio cativos, solo si no es factible el analizar para residuos de ciertos productos se podría seleccionar métodos inespecíficos como el TOC o la conductividad
- Se debe usar un racional científico para la selección del peor caso que debe estar basado en criterios de solubilidad, facilidad de limpieza, toxicidad y potencia.
- El límite de limpieza del peor caso debe ser el límite inferior obtenido a partir de los datos de PDE.
- En el caso de que el límite de cuantificación del método analítico sea superior al límite teórico de limpieza a alcanzar, habrá que tomar medidas como dedicar partes del equipo (disminuir la superficie de contacto) o desarrollar un nuevo método analítico. . Si aun así el límite de cuantificación fuese superior al límite calculado se requerirá instalaciones dedicadas tal como indica el capítulo 5 de las GMPs
“Se requieren instalaciones dedicadas para la fabricación cuando los límites de residuos relevantes, derivados de la evaluación toxicológica no pueden determinarse satisfactoriamente por un método analítico validado”.
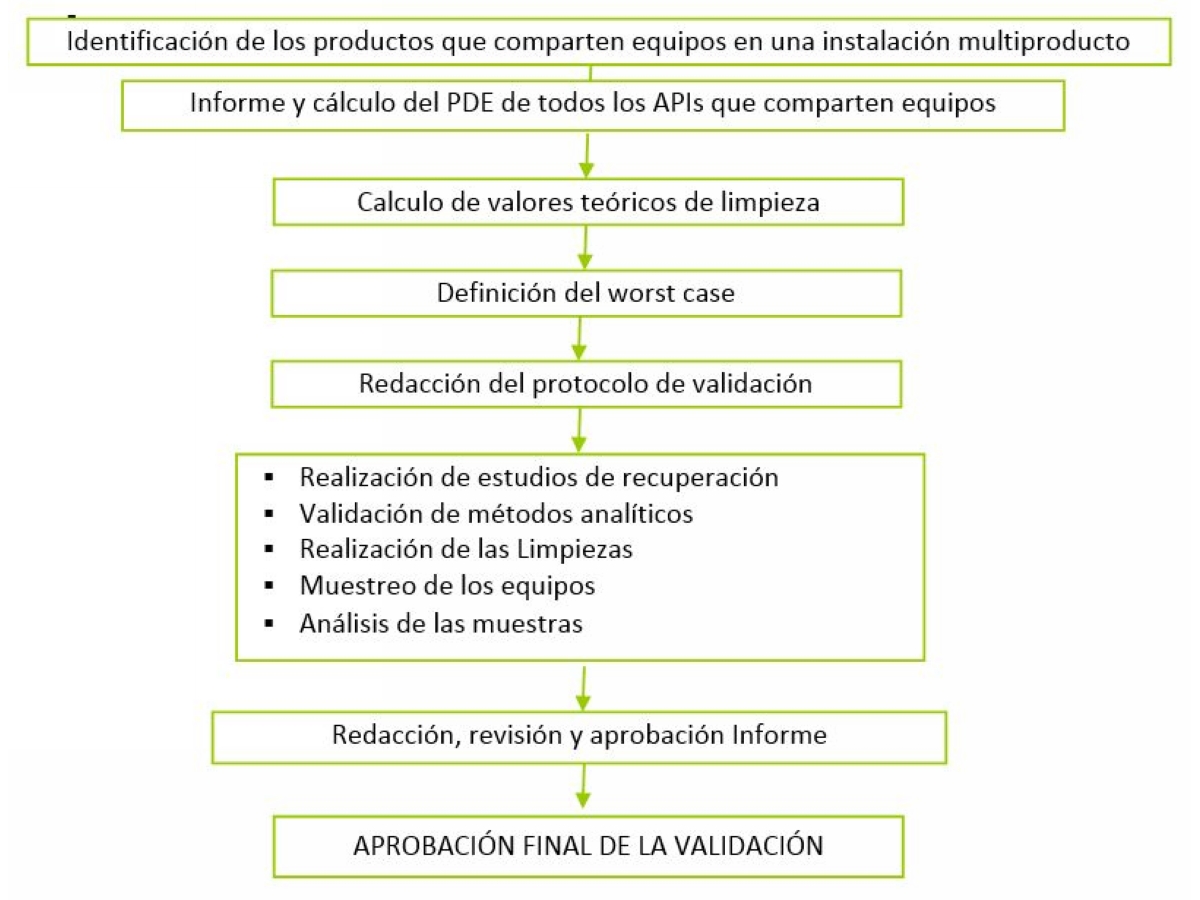
PASOS A SEGUIR
Se resume en el siguiente diagrama:
SOPORTE QUALIPHARMA
Qualipharma puede gestionar de una manera integral un proyecto de validación de limpieza :
- Formación
- Informes PDE
- Calculo de límites de limpieza
- Definición del worst-case
- Realización de protocolo de limpieza
- Métodos analíticos de limpieza
- Realización de informes
Validaciones de procesos de limpieza
Qualipharma dispone de la experiencia y los recursos necesarios para dar soporte en la generación de la documentación necesaria para diseñar y demostrar que los procesos de limpieza existentes son eficaces y óptimos

1 comentarios
Claudia Ramirez
muy buena información